| “国药动保”推荐阅读【遗传改良】MicroRNA调控多不饱和脂肪酸合成关键酶研究进展 | |||||
|
|||||
|
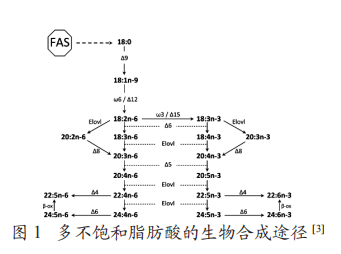
原创 李飙,马海明 猪业科学 昨天 摘要 microRNA(miRNA)是生物体内自然存在的一种非编码小RNA,能够靶向调控众多基因的表达,进而参与多种生命活动的调节。脊椎动物体内长链多不饱和脂肪酸(LC-PUFA)的生物合成,如花生四烯酸(ARA;20∶4n-6)、二十碳五烯酸(EPA;20∶5n-3)和二十二碳六烯酸(DHA;22∶6n-3)等脂肪酸合成需要脂肪酰基去饱和酶(Fads)的催化。早已有研究表明,中国地方猪种肉质优于瘦肉型猪种,究其原因是中国地方猪种肌肉和脂肪中含有大量不饱和脂肪酸等风味物质。然而LC-PUFA研究是一个蓬勃发展的领域,主要集中在人类健康方面,但对于猪肉中LCPUFA生物合成关键酶转录后水平调控机制还没有形成一个完整的观点。miRNA可能参与转录后水平的脂质代谢调控。然而,它们是否影响了LC-PUFA生物合成途径中的作用尚不清楚。文章综述了一些靶向关键去饱和酶和延长酶的miRNA在调控动物LC-PUFA合成的表达模式和调控机制。 关键词 miRNA;多不饱和脂肪酸;脂肪酸去饱和酶;脂肪酸延长酶 多不饱和脂肪酸(ployunsatura tedfatty acids,PUFA)是机体不可缺少的必需脂肪酸,而长链(≥C20)多不饱和脂肪酸(LC-PUFA)具有PUFA的高度生物活性形式,其生物学功能以及与机体健康的关系一直是国际关注和研究的热点。大量研究表明,PUFA更具体地说,n-3LC-PUFA,如二十碳五烯酸(EPA;20∶5n-3)和二十二碳六烯酸(DHA;22∶6n-3)不仅参与信号传递和调节脂质代谢、炎症反应和细胞分裂以及相关基因表达等方面发挥重要作用,还能预防动脉粥样硬化的形成和发展、预防脑血栓、脑溢血、高血压等心血管疾病,被称为“血管清道夫”。饱和脂肪酸和单不饱和脂肪酸可以被所有生物体生物合成,而PUFA通常必须在动物的饮食中获得,尽管它们可以在某些物种中转化为长链(C20-24)PUFA(LC-PUFA)。C18PUFA利用有氧前端脂肪酸去饱和酶(Fads)和脂肪酸延长酶(ElovL)的途径生成LC-PUFA(如图1)。该途径中最不饱和的产物DHA和22∶5n-6的底物分别为18∶3n-3和18∶2n-6。所涉及的酶对n-3和n-6系列脂肪酸均有作用,一般都偏爱n-3。以n-3例,EPA的生成需要Δ6去饱和酶和Δ5去饱和酶分别从α-亚麻酸(ALA;18∶3n-3)去饱和生成18∶4n-3,从20∶4n-3去饱和生成EPA;另一个途径是ALA延长生成20∶3n-3后紧接着通过Δ8和Δ5去饱和酶去饱和作用生成EPA。在某些鱼类,可以直接通过EPA延伸产物22∶5n-3利用Δ4去饱和酶生产DHA。但在哺乳动物中,从EPA到DHA似乎涉及到一个更复杂的路径,该途径是脊椎动物中最普遍的DHA生物合成途径——“Sprecher通路”,EPA需要连续两个碳链延长产生24∶5n-3,然后通过△6-脱氢酶的去饱和作用生成24∶6n-3,最后通过过氧化物酶催化脂肪酸的β-氧化缩短碳链生成二十二碳的DHA。另一种是“Δ4去饱和酶通路”,△4途径一般发生在低等生物中,是EPA转化为DHA的主要途径,然而HuiGyuPark等人在细胞中证实,二十二碳五烯酸(DPA,22∶5n-3)和肾上腺酸(ADA,22∶4n-6)直接通过FADS2基因产物通过△4脱氢形成不饱和键,分别生成DHA,这为探究FADS2基因功能提供一条新思路。然而两种途径都首先需要乙酰辅酶A羧化酶(Acetyl CoA carboxylase,ACC)和脂肪酸合成酶(fatty acid synthase,FAS)两种胞质酶进行合成,然后在脂肪酰基去饱和酶(Fads)和超长链脂肪酸(ElovL)蛋白的两组酶的协同作用下对脂肪酸进一步延长和去饱和,从而获得碳链较长的不饱和脂肪酸。
MicroRNA(miRNA)是一类内源的、进化保守的小非编码RNA,其长度约为22个核苷酸(nt)。具有典型的发夹环结构,在真核生物的基因组上,最初RNA聚合酶II从基因间区域或重叠基因(蛋白质编码或非编码)中编码的初级转录本转录为初级miRNA(pri-miRNA)。然后裂解核酸内切酶Drosha,在细胞核内形成前体miRNA(pre-miRNAs,约70nt)。然后,前miRNA被另一种内切酶Dicer处理,在细胞质中产生22nt长度的具有功能的miRNA成熟体。与长链非编码RNA、环状非编码RNA和piRNA等其他非编码RNA相比,miRNA的调控机制相对简单。通常,成熟的miRNA通过其“种子区”(miRNA的5'端的2~8个核酸序列)能够与靶基因的3'非翻译区(3'UTR)部分或完全互补结合,使mRNA不稳定,翻译延迟或抑制目标基因的表达。在哺乳动物物种中,据估计只有1%~5%的基因组转录本编码miRNA,但是多达60%的基因直接或间接受miRNA调控。目前在动物上发现和确认的miRNA在不断增多。有人提出一种miRNA可以调节数百种mRNA的表达,而一种mRNA的表达又可以同时被数百种miRNA调节。换句话说,miRNA可以通过在生物体中构建复杂的调控系统,凭借对大量靶基因的调控,miRNA参与机体内的多种生命活动,除了细胞的增殖、分化、死亡、应激反应、胞内代谢和信号传导。同时越来越多的研究表明,miRNA在脂质代谢中起着重要的调控作用。例如,在哺乳动物肝脏中大量表达的miR-122可以特异性通过靶向阳离子氨基酸转运蛋白1(Cpt1α)的调节来调节肝脏蛋白质的代谢;同时还可以通过抑制参与胆固醇生物合成的基因的表达来调节肝脏脂肪酸和胆固醇的合成。此外,miR-33a/b靶向参与脂肪酸氧化调节的关键酶,包括肉碱O-辛基转移酶,肉碱棕榈酰转移酶1A,羟酰基-CoA-脱氢酶,Sirtuin6(SIRT6)和AMP激酶亚基-α,并协同调节胆固醇稳态;miR-33a/b也靶向胰岛素受体底物2,这是肝脏中胰岛素信号通路的重要组成部分;miR-27a/b通过靶向PPARγ抑制脂肪细胞分化和甘油三酸酯的积累,参与肥胖中的脂肪组织失调,表明脂质代谢相关基因转录后沉默调控的另一重要元素需要依赖miRNA。
无论无脊椎动物还是猪、牛等脊椎动物,都拥有编码LC-PUFA生物合成途径中涉及的去饱和酶和延长酶的基因,尽管其确切的功能和受到非编码RNA调控功能仍有待阐明。
1 miRNA对PUFA合成途径关键去饱和酶的调控与机制 生物血液和组织PUFA浓度由膳食摄入和内源性合成共同决定,通过膳食前体亚油(18:2n-6,LA)和a-亚麻酸(18:3n-3,ALA)的连续伸长和去饱和。Δ5去饱和酶和Δ6去饱和酶参与了这一酶过程,分别由两个同源直系基因FADS1和FADS2基因编码。FADS1和FADS2基因与FADS3基因位于染色体11q12-q13.1上的一个簇中。该基因簇由92kb组成,头对头方向为FADS1和FADS2,尾对尾方向为FADS2和FADS3。FADS1和FADS2的内含子1被一个11.4kb的区域隔开,FADS3位于FADS2的6.0kb端粒侧(如图2)。FADS3的生物学功能尚不清楚。
肝脏是参与PUFA生物合成的主要器官,也是FADS1和FADS2表达的主要部位。Li等在研究20周龄和30周龄母鸡的肝脏microRNA表达差异中,首次发现FADS1被miR-365-3p,miR-218-5p,miR-181a-5p,miR-181b-5p,miR-29a-3p和miR-23b-3p靶向,而FADS2被miR-30c-1-3p靶向。这项研究为miRNA在脂质代谢分子调控系统中的详细功能提供了基础资源。Zhang等通过双荧光素酶报告证明了,mir-17在河豚原代肝细胞(Schl)中直接靶标Δ4FAD的3'UTR,影响了FAD1和FADS2的表达,参与了LC-PUFA生物合成的调控。除了直接靶向以外,还有间接调控FADS上游基因。他还发现miR-33在Schl中靶向胰岛素诱导的基因1(insig1),阻断了LC-PUFA生物合成的激活因子甾醇调节元件结合蛋白-1(Sembp1)的蛋白水解激活,从而抑制LC-PUFA生物合成的关键酶Δ4、Δ6、Δ5脂酰去饱和酶(FADs)的表达。除此之外,Chen等也发现通过Insig1/Srebp1通路轴调控LC-PUFA生物合成的还有miR-24。
在猪等脊椎动物中,无论是胚胎时期,还是出生后及成年,每个生命时期的肝代谢程序转换是一个复杂的分子调控系统。例如,刚孵出的小鸡在孵化后这些卵黄脂质会迅速消耗殆尽,新陈代谢转化为由碳水化合物为基础的能量来源,由于消化系统发育不良,不能像成年鸡那样有效地利用饲料;通过采用延迟喂养48h来阻止肝脏代谢转换,发现延迟喂养导致miR-20b表达增加,而其靶标FADS1的表达相反地减少;表明在转录前后,FADS1基因受到miRNA介导,参与了这一转换。同时miR-33的表达显著降低,miR-33是脊椎动物中著名的脂质代谢调节剂,已有报道在鸡中被证明具有抑制肝脏脂肪酸氧化的作用,此结果进一步支持了miR-33在调节肝脏脂质代谢中的作用,表明它是鸡代谢开关的重要转录后调节因子。提示在肝代谢转换时期,脂肪酸的从头合成可以几乎被抑制,这可能由于SREBF1及其下游FADS的表达减少所致,而miRNAs在这种代谢转换过程中是肝脏代谢通路的关键调控因子。
2 miRNA对PUFA合成途径关键延长酶的调控与机制 脂肪酸延长酶(elongase of very long chain fattyacids,ELOVL)是位于内质网上的膜结合蛋白酶,主要参与延长循环反应中的第一个缩合反应。哺乳动物中发现的延长酶家族种类最多,含有7个成员,分别为ELOVL1~ELOVL7,其对不同的脂肪酸底物表现出不同的底物特异性。ELOVL1、ELOVL3、ELOVL6和ELOVL7主要延长饱和以及单不饱和脂肪酸,但不参与长链PUFA的伸长;而ELOVL2、ELOVL4和ELOVL5与鱼类全长cDNA序列具有高度同源性,功能也具有相似性,主要催化多不饱和脂肪酸的延长反应中C18和C20PUFA底物的碳链延伸。
2.1 ELOVL2 ELOVL2是长链多不饱和脂肪酸合成中的关键延长酶,其主要参与DHA前两步合成过程,即由EPA转化为二十二碳五烯酸(DPA,22∶5n-3),以及进一步延长为24∶5n-3。然而,小鼠的ELOVL2能够在一定程度上可延长18∶3n-6,而人类的ELOVL2则不能,这表明不同物种之间可能存在一些功能差异。在人原发性肝细胞(PHHs)去分化的研究中,发现了ELOVL2在去分化PHHs中下调,这与超长链PUFA浓度降低一致;此外,还发现在去分化过程中出现多种miRNA差异表达,提示在PHHs去分化过程中miRNA通过调控ELOVL表达参与PHH脂质的合成、积累和分泌。
2.2 ELOVL5 ELOVL2和ELOVL5酶在哺乳动物的大多数组织中普遍表达。尽管ELOVL5在大鼠中可能存在物种差异,在肺和大脑中表达最高,而人类的ELOVL5在睾丸和肾上腺中表达尤其高,其特征为22∶5n-6水平相对较高。这两个延长酶具有重叠的生理功能,ELOVL5能够延长C18C20PUFA,但对C22没有活性,而ELOVL2能够延长C20和C22PUFA,但ELOVL2和ELOVL5对饱和脂肪酸和单不饱和脂肪酸都没有活性。
许多研究证明ELOVL5对C18和C20为底物的脂肪酸的转化活性具有重要性。Chen等首次发现miR-146a可能通过靶向ELOVL5参与调控SCHL细胞LC-PUFA生物合成,并发现miR-146a过表达显著降低了依赖于ELOVL5的PUFA延长指数,如20∶3n-6/18∶3n-6、20∶4n-3/18∶4n-3、22∶5n-3/20∶5n-3,从而降低了SCHL细胞的LC-PUFA含量。
已有文章报道ELOVL5通过参与控制脂肪细胞甘油三酯脂肪酶(也称为蛋白样磷脂酶结构域,patatin-like phospholipase domain)的丰度,从而调节甘油三酯(TG)水平来调节脂质代谢;而在此脂质代谢调节过程中miRNA可能发挥了正向调控作用。Li等通过生物信息学分析预测出ELOVL5是miR-21-3p的靶基因,随后实验中被证实,在乳腺上皮细胞(MECs)中表达bta-miR-21-3p促进了甘油三酯的产生,这可能与靶基因ELOVL5的调控有关。除此之外,Zhang等在雌性激素处理的产蛋期鸡的原发性肝细胞中发现6个miRNA显著下调,并且证miR-218-5p可以直接靶向ELOVL5,发现雌激素可以上调ELOVL5的表达,间接促进产蛋母鸡肝脏中LCPUFA的合成,而此调控可能依赖与miRNAs。综上所述,ELOVL5可被多个miRNA直接调控影响LCPUFA的合成,同时ELOVL5也可以受到其他因子保护不受miRNA介导的影响,这也间接说明了ELOVL5在脂肪及碳水化合物的代谢的重要性。
2.3 ELOVL6 ELOVL6的主要功能是催化单不饱和脂肪酸的合成,比如催化C16脂肪酸延伸为C18;其主要在肝脏、脂肪组织和肾上腺等脂质含量较高的组织或器官中表达较高。ELOVL6基因是影响脂肪酸合成的关键基因,是将棕榈酸转化成进一步延伸成硬脂酸的限速酶;除此之外,ELOVL6还是参与维持机体脂肪酸代谢平衡的关键因子,在最新的研究中发现ELOVL6与胰岛素抵抗,非酒精性脂肪肝和肝炎动脉粥样硬化等发病机理有关联。深入研究ELOVL6基因有助于了解肝脏中脂肪酸的组成变化机制。
已有报道ELOVL6在过氧化物酶体增殖物激活受体(PPAR)和脂肪酸代谢信号通路中发挥关键作用。ELOVL6不仅可以直接调控机体的代谢作用,还可以在其他基因调控中发挥作用。在HepG2细胞中碳水化合物反应元件结合蛋白(carbohydrate response element binding protein,ChREBP)和固醇调节元件结合蛋白-1C(sterol regulatory elementbinding protein-1C,SREBP-1C)的异位共表达可以协同刺激ELOVL6启动子;Moon等[33]人研究发现ELOVL6的表达还可以同时受到SREBP-1和肝X受体α(LXRα)的直接调控,但SREBP-1a对ELOVL6的诱导作用更显著。此外,ELOVL6在不同动物组织中还可以被miR-22-3P、mir-144、miRNA-125a-5p等多种miRNA直接调控;当ELOVL6表达被抑制时,棕榈酸(C16∶0)含量显著增加,而油酸(C18∶1,n-9),二十碳烯酸(C20∶1,n-9)和二十碳三烯酸(C20∶3)含量显著降低,表明miRNAs可以影响ELOVL6的表达来调节一些细胞中饱和脂肪酸和长链不饱和脂肪酸的含量。不仅如此,在脂肪细胞的生长发育研究中,证实了ELOVL6为miR‐204的直接靶基因,参与调控脂肪细胞的成脂分化,猜测ELOVL6可能是mir-204与脂肪分化直接调节因子之间的中间调节因子。
3 miRNA对硬脂酰辅酶A去饱和酶(SCD)的调控与机制 单不饱和脂肪酸是合成PUFA的底物。硬脂酰辅酶A去饱和酶(Stearoyl-CoA desaturease,SCD)也称为Δ9去饱和酶,是肝细胞催化饱和脂肪酸(Saturated fatty acid,SFA)C9脱氢形成n-9系单不饱和脂肪酸(monounsaturated fatty acid, MUFA)的关键限速酶,分别转化生成油酸(OA,C18∶1)与棕榈油酸(PA,C16∶1)。多不饱和脂肪酸(PUFA)不仅是体内能量的重要来源,而且是生物膜的重要组成成分。而这两种物质是合成膜磷脂和中性脂(包括甘油三酯和胆固醇酯等)的重要底物。故SCD基因的表达或者酶活性的改变将会影响细胞内饱和脂肪酸与不饱和脂肪酸的比例,进而影响膜磷脂的组成,这对维持细胞膜的流动性及信号传递等很重要。
有文章指出SCD表达变化与硬脂酸和油酸的比例改变直接相关,这将会影响生物膜的流动性以及信号转导过程,进一步影响细胞的生长与分化。除了已报道的共轭亚油酸、乙醇、类固醇激素等多种外源因素会影响肝脏SCD的活性外,许多内源因子也会改变SCD的功能表达。Tan等研究发现miR-199a-3p可以直接靶向调控硬脂酰辅酶a去饱和酶(SCD)的表达,从而抑制了3T3-L1脂肪细胞的脂质积累,并参与脂质转录、脂肪酸合成,尤其影响脂肪酸转运的脂肪细胞特异性基因的表达显著下降,而脂肪酸氧化过程得到了增强。SCD被直接靶向调控还有miR-125b、miR-192、miR-29a,均参与脂滴积累和MUFA的组成。除此之外,SCD还可以和脂肪酸合成酶(FAS)共同被miR-212-5p、miR-27a直接靶向,影响肝细胞甘油三酯(TG)的积累。
本文选自《猪业科学》2020年第6期“遗传改良”栏目:P106-110(版权归《猪业科学》所有,如转载,请注明出处)。阅读更多内容可见网站:http://www.csis.cn。
《猪业科学》征稿
如您有好的文章希望与广大同仁分享,请将稿件发至邮箱:
swineonline@263.net
招聘启事
《猪业科学》(月刊)杂志自2006年更名以来,受到业界普遍关注和欢迎。据中国知网统计,该刊物成为行业刊登文章、发行量、广告刊登、订阅量之最。目前实施全媒体拜访报道,多平台联动呈现发展战略,需要大批有志青年,面向社会招聘实习生或毕业生。
联系人:孙德林 电话:13701057839 E_mail:delin518@x263.net
|
|||||
|